FACULDADE DE
ENGENHARIA DA UNIVERSIDADE DO PORTO
Departamento de Engenharia Química
Projecto de Investigação
Oxidação Química com Reagente de Fenton

Joaquim Pedro Castro
Patrícia Faria
Julho 2001
Agradecimentos
No
decorrer deste projecto de investigação deparámos com obstáculos que não seriam
transponíveis sem a ajuda dos nossos orientadores.
Fica
o nosso agradecimento aos professores
Doutor
Miguel Madeira
Os autores,
Resumo
O
objecto de estudo deste Projecto de Investigação centra-se na tecnologia do tratamento
de efluentes com elevada Carência Química de Oxigénio (CQO), por oxidação
química com Reagente de Fenton.
Para
tal, foi realizada uma pesquisa bibliográfica sobre estudos realizados
anteriormente centrados neste tema, bem como várias experiências realizadas em
reactor fechado e em reactor semi-contínuo, à escala piloto.
Um
dos objectivos principais deste projecto consistiu na confirmação da
possibilidade da utilização de um eléctrodo de ORP como modo de monitorizar o
seguimento da reacção.
Numa
segunda fase investigou-se a possibilidade de aplicação deste tratamento para
remoção de cor e de Carbono Orgânico Total (TOC), de um efluente sintético
corado.
Finalmente
estudou-se a influência da temperatura, do pH, da dosagem de Ferro e de
Peróxido de Hidrogénio na remoção de cor, neste efluente, associada ao
tratamento de Fenton.
Os
vários estudos efectuados anteriormente neste domínio, utilizam o valor de CQO
para quantificar a eficiência de remoção de matéria orgânica. Neste estudo
optou-se por utilizar o valor de TOC. São várias as razões que motivaram esta
escolha. Por um lado, a medição da CQO não fornece uma informação tão correcta
da quantidade de carbono orgânico em solução. Por outro lado é um método mais
vulnerável a interferências, nomeadamente, à presença de outras espécies
redutoras, como seja o Fe2+.
O
seguimento da reacção de Fenton pode ser monitorizado através do valor de ORP
da mistura reaccional. Pode também utilizar-se a medição de temperatura para o
mesmo efeito, no entanto é aconselhável a utilização dos dois métodos para uma
monitorização mais eficiente.
Obteve-se,
na solução de violeta de cristal 5´10-5 M, uma remoção de cor de 99 % e uma remoção de TOC de 67 %.
Índice
1.2.1 Mecanismo da Reacção de Fenton 9
1.2.2 Factores condicionantes da reacção 21
1.2.4 Métodos de monitorização da reacção 22
1.4 Limitações do tratamento de Fenton 25
1.5 Novas tecnologias do Fenton 26
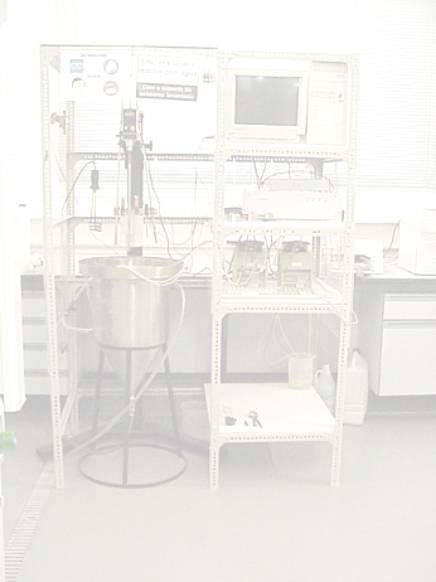
2.1 Instalações experimentais 27
2.1.1 Reactor semi-contínuo 27
2.2 Carbono Orgânico Total (TOC) 29
2.3 Caracterização dos efluentes 30
3. Descrição das
experiências 31
3.1 Experiências em reactor semi-contínuo 31
3.1.1 Descrição experimental 31
3.1.2 Resultados e discussão 31
3.2 Experiências em reactor fechado 37
3.2.1 Descrição experimental 37
3.2.2 Resultados e discussão 37
5. Propostas
para investigações futuras 44
Anexo 1 – Reactor semi-contínuo 47
Anexo 2 – Variação de volume em reactor semi-contínuo 48
Anexo 4 - Exemplo de cálculo do teor de TOC 50
1. Introdução
Os limites impostos pela legislação no que concerne à toxicidade dos
efluentes industriais para descarga são cada vez mais exigentes. Estas medidas
surgem devido à crescente contaminação do meio ambiente e à degradação de
grande parte dos seus recursos naturais.
Na indústria química é bastante frequente a produção de efluentes com altas
concentrações em compostos orgânicos tóxicos. Estes efluentes apresentam,
invariavelmente, elevados valores de TOC. Este facto reveste de grande
importância o tratamento de tais efluentes antes da sua descarga no meio
ambiente.
1.1 Oxidação Química
A oxidação química é um processo que demonstra grande potencial no tratamento
de efluentes contendo compostos tóxicos não biodegradáveis. Através de reacções
químicas de oxidação podem degradar-se componentes orgânicos tóxicos, diminuir
a CQO e a intensidade de cor dos efluentes.
Os processos oxidativos convencionais utilizam como agentes oxidantes o
oxigénio, ozono, cloro, hipoclorito de sódio, dióxido de cloro, permanganato de
potássio e peróxido de hidrogénio. [1]
Existem numerosos compostos que são resistentes à acção directa dos agentes
oxidantes convencionais. Nestes casos torna-se necessário recorrer a processos
de oxidação avançados.
Os processos oxidativos avançados baseiam-se na formação de radicais
hidroxilo (.OH). Estes
radicais têm um potencial de oxidação bastante elevado (E0=2,3V) [2]
e são capazes de reagir com praticamente todas as classes de compostos
orgânicos.
A grande vantagem destes processos é serem processos destrutivos, isto é,
os contaminantes são destruídos quimicamente em vez de sofrerem apenas uma
mudança de fase como sucede, por exemplo, em processos de adsorção, filtração,
etc. Se a extensão da oxidação for suficiente, pode até atingir-se a total
mineralização dos compostos orgânicos e obter CO2, H2O e
iões inorgânicos.
Os vários processos de oxidação química avançada, encontram-se divididos em dois grupos: Processos Homogéneos e Processos Heterogéneos. Os primeiros ocorrem numa única fase e utilizam ozono, peróxido de hidrogénio ou reagente de Fenton como geradores de radicais hidroxilo. Os segundos utilizam semicondutores como catalisadores (dióxido de titânio, oxido de zinco, etc). A utilização de radiação UV e as propriedades semicondutoras do catalisador permitem a formação dos radicais hidroxilo e a consequente oxidação do efluente. A fotocatálise heterogénea tem sido bastante estudada tanto com o catalisador em suspensão como suportado em reactores [2]. Diversos tratamentos de oxidação avançada estão apresentados na tabela 1.
Tabela 1 – Processos de oxidação química avançada [2]
|
HOMOGÉNEOS |
HETEROGÉNEOS |
||
|
Com irradiação |
sem irradiação |
Com irradiação |
sem irradiação |
|
O3/UV |
O3/H2O2 |
Cat./UV |
Electro-Fenton |
|
H2O2/UV |
O3/OH- |
Cat./ H2O2/UV |
|
|
O3/H2O2/UV |
H2O2/Fe2+(Fenton) |
|
|
|
VUV |
|
|
|
Por vezes o nível de toxicidade de um efluente é bastante alto,
impossibilitando o tratamento pelos métodos biológicos convencionais. Nesta
situação a oxidação química pode ser utilizada como um pré-tratamento,
diminuindo a toxicidade a montante de um processo biológico convencional. Pode
também ser utilizada como pós-tratamento, para oxidar resíduos não
biodegradados no processo biológico.
1.2 Reagente de Fenton
Em 1876, H.J.H. Fenton observou pela primeira vez as propriedades
fortemente oxidantes de uma solução de peróxido de hidrogénio e iões Fe2+.[3]
Utilizando este reagente muitas moléculas orgânicas podiam ser facilmente
oxidadas sem recorrer a altas pressões, altas temperaturas ou equipamento
complexo.
A Reacção de Fenton, definida hoje como a geração catalítica de radicais
hidroxilo a partir da reacção em cadeia entre o ião ferroso (Fe2+) e
o peróxido de hidrogénio (H2O2), em meio ácido, tem
demonstrado ser bastante eficiente na oxidação de compostos orgânicos tóxicos e
não biodegradáveis [4].
1.2.1 Mecanismo da Reacção de Fenton
O mecanismo de geração catalítica de radicais hidroxilo, provado e aceite
desde 1971, está descrito de seguida [4].
![]() Fe2+ + H2O2 Fe3+ + OH- + HO. (1)
Fe2+ + H2O2 Fe3+ + OH- + HO. (1)
![]() Fe2+ + HO. Fe3+
+ OH- (2)
Fe2+ + HO. Fe3+
+ OH- (2)
![]() H2O2 + HO. HO2. + H2O (3)
H2O2 + HO. HO2. + H2O (3)
![]()
![]() Fe2+ + HO2. Fe3+
+ HO2- H2O2 (4)
Fe2+ + HO2. Fe3+
+ HO2- H2O2 (4)
![]() Fe3+ + HO2. Fe2+
+ H+ + O2 (5)
Fe3+ + HO2. Fe2+
+ H+ + O2 (5)
![]() Fe3+ + H2O2 Fe2+ + HO2. + H+ (6)
Fe3+ + H2O2 Fe2+ + HO2. + H+ (6)
O estudo deste mecanismo, realizado por Metilitsa, levou às seguintes
conclusões:
Com o excesso de iões Fe2+ ocorrem preferencialmente as reacções
(1) e (2); Com o excesso de H2O2 em meio ácido ocorrem
preferencialmente as reacções (1), (3) e (4) e as reacções (5) e (6) são
desprezáveis. Para concentrações semelhantes de Fe2+ e H2O2
ocorrem apenas as reacções (1), (2), (3) e (4).
Em 1949 Mertz e Waters demonstraram que a oxidação da matéria orgânica com
reagente de Fenton pode ocorrer através de uma mecanismo de reacção em cadeia
na qual a etapa limitante é a formação de radicais hidroxilo [4].
![]() Fe2+ + H2O2 Fe3+ + OH- + HO. (7)
Fe2+ + H2O2 Fe3+ + OH- + HO. (7)
![]() R-H
+ HO. R. + H2O (8)
R-H
+ HO. R. + H2O (8)
![]() R. + H2O2 ROH + HO. (9)
R. + H2O2 ROH + HO. (9)
![]() Fe2+ + HO. Fe3+
+ OH- (10)
Fe2+ + HO. Fe3+
+ OH- (10)
![]() R. + HO. ROH (11)
R. + HO. ROH (11)
![]() 2 R. Produtos (12)
2 R. Produtos (12)
No que diz respeito à cinética da reacção, os estudos realizados anteriormente
estão condicionados quer pelo tipo de substracto orgânico presente no efluente,
quer pelas condições em que se realiza a oxidação. No entanto, é consensual que
a temperatura, a quantidade de matéria orgânica, as concentrações de peróxido e
de ferro influenciam a velocidade de reacção. Vários estudos indicam que a
reacção global com reagente de Fenton é de primeira ordem em relação à
concentração de substracto orgânico no efluente [1].
1.2.2 Factores condicionantes da reacção
pH
Vários estudos apontam o pH como um factor determinante na eficiência da
reacção. O resultado desses estudos é praticamente consensual quanto ao valor
de pH adoptado, e este não depende do tipo de efluente a tratar. O pH óptimo
situa-se entre 3 e 5.
O abaixamento da eficiência da reacção para pH superiores a 5 deve-se à
transição dos iões Fe2+ hidratados para espécies coloidais férricas
- Fe(OH)3. Estas espécies decompõe catalíticamente o peróxido de
hidrogénio em oxigénio e água, impedindo a formação de radicais hidroxilo [5].
Além desse efeito, a precipitação do Ferro na forma de hidróxido diminui a
quantidade de catalisador disponível para a produção de radicais hidroxilo.
Um exemplo de evolução do pH ao longo da reacção, no caso de este não ser
controlado, pode ser observada na figura 2 [4].
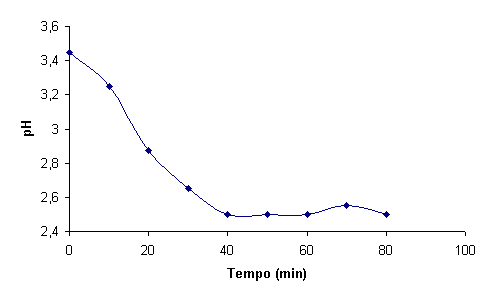
Figura 1 – Evolução típica do pH ao longo da reacção em reactor fechado [4]
Tal evolução é explicada pela decomposição do substracto orgânico em ácidos orgânicos. Frequentemente o valor de pH é controlado para garantir que a reacção ocorra nas condições óptimas.
Temperatura
Apesar de se tratar de uma reacção exotérmica, verifica-se que a velocidade
de reacção aumenta com o aumento da temperatura. No entanto não é conveniente tratar
o efluente a temperaturas superiores a 40-50 ºC, dado que ocorre a decomposição
do peróxido em oxigénio e água. Os estudos consultados referenciam temperaturas
de operação entre 20 e 30 ºC. Alguns desses estudos apontam temperaturas
próximas de 30 ºC para máxima remoção de CQO.
Deve atender-se a uma moderação da temperatura, não só por razões económicas mas também por motivos de segurança. A segurança de uma instalação para tratamento de Fenton é abordada na secção 2.1.1.
Concentração de Ferro
Na ausência de Ferro não se verifica formação de radicais hidroxilo.
Aumentando a dose de ferro e fixando todos os outros parâmetros, obtém-se
maiores remoções de CQO. Porém, a partir de uma dada concentração, um aumento
na dosagem de Ferro não causa uma maior remoção. Este facto leva a crer que
existe uma quantidade óptima de catalisador a utilizar. Vários estudos indicam
que uma razão mássica de Fe:H2O2 de 1:5 provoca uma
remoção de CQO e de cor que não são melhoradas pela adição de uma maior
quantidade de Ferro [6].
1.2.3 Coagulação
No final do tratamento de Fenton é necessário neutralizar a mistura
reaccional, que apresenta um pH ácido. Devido à existência de ferro na solução,
a elevação do pH provoca a formação de hidróxidos de Ferro, que precipitam
formando lamas.
Segundo Kang e Hwang esta etapa contribui para a remoção de uma percentagem
significativa de TOC.
1.2.4 Métodos de monitorização da reacção
Numa instalação semi-contínua de tratamento de águas residuais com reagente
de Fenton, é importante ter um critério de paragem da reacção. Para tal, é
necessário um meio de poder avaliar a extensão da reacção à medida que ela
avança.
Uma possibilidade é a monitorização da temperatura. As transformações
químicas envolvidas são exotérmicas. À medida que a reacção decorre a
temperatura vai aumentando gradualmente até estabilizar. A partir dessa altura
supõe-se que a reacção abranda e que a remoção de TOC não será significativa.
No caso de se tratar um efluente corado, pode utilizar-se a medição de
absorvância como seguimento de reacção. Porém, vários estudos indicam que a
velocidade de remoção de cor é bastante superior à de remoção de TOC.
Um método muito utilizado é a monitorização através de um eléctrodo de ORP
(Potencial de Oxidação-Redução). O consumo de radicais hidroxilo traduz-se numa
diminuição do valor de ORP. Assim, quando a velocidade de reacção é máxima, o
valor de ORP atinge um valor mínimo, voltando a subir se a adição de peróxido
não for interrompida. A validade deste tipo de monitorização como critério de
paragem é um dos objectos de estudo deste trabalho e será desenvolvido na
secção 3.1.2 - TOC e ORP.
O melhor método de monitorização será, certamente, uma combinação dos
métodos descritos anteriormente.
1.3 Aplicações
O reagente de Fenton é aplicado essencialmente no tratamento de águas
residuais, lamas e na remediação de solos contaminados. Entre os vários efeitos
obtidos como o tratamento de Fenton destacam-se [5]:
- Degradação
da matéria orgânica
- Diminuição
da toxicidade
- Aumento
da biodegradabilidade
- Diminuição
da CBO, CQO e TOC
- Remoção
de cor e de odor
Este tratamento pode ser aplicado a uma grande variedade de compostos
orgânicos que não são passíveis de receber tratamento biológico. Na tabela 2
estão listados alguns dos compostos que podem ser oxidados com reagente de
Fenton [6].
Tabela 2 – Compostos que podem ser oxidados pelo reagente de Fenton [6]
|
Ácidos Álcoois Aldeídos Eteres |
Fórmico Glucónico Láctico Malico Propiónico Tartárico Benzílico terc-Butílico Etanol Etileno-glicol Isopropanol Metanol Propenodiol Acetaldeído Bezaldeído Formaldeído Glioxal Isobutilaldeído Tricloroacetaldeído Tetrahidrofurano |
Aromáticos Aminas Corantes Cetonas |
Benzeno Clorobenzeno Clorofenol Diclorofenol Hidroquinona p-Nitrofenol Fenol Tolueno Triclorofenol Xileno Trinitrotolueno Anilina Aminas cíclicas Dietilamina Dimetilformamida EDTA Propanodiamina n-Propilamina Antraquinona Diazo Monoazo Dihidroxiacetona Metiletilcetona |
As
principais indústrias químicas que utilizam o Fenton para o tratamento das suas
águas residuais são [6]:
- Farmacêutica
- Produção de insecticidas
- Produção de tintas e corantes
- Explosivos
- Plásticos
- Petroquímica
1.4 Limitações do tratamento de Fenton
Existem
variadas limitações inerentes à utilização do reagente de Fenton. Como já foi
referenciado, alguns compostos orgânicos não são oxidados neste processo. Por
outro lado, poderá haver a formação de outros compostos que serão igualmente
tóxicos e que comprometam a aplicabilidade do tratamento. Convém não esquecer
que se adiciona um alto teor de ferro à solução o que, só por si, não é muito
vantajoso. As lamas formadas requerem tratamento apropriado, o que implica um
aumento do custo de tratamento.
Existem, porém, limitações ao poder oxidativo do reagente de Fenton. Na
tabela 3 estão listados alguns dos compostos que não são passíveis de ser
oxidados.
Tabela 3 – Compostos que o reagente de Fenton não oxida [6]
|
Ácido
acético Acetona Tetracloreto
de carbono Clorofórmio Ácido
Maleico |
Ácido
Oxálico n-parafinas Tetracloroetano Tricloroetano Ácido
Malónico |
1.5 Novas tecnologias do Fenton
Foto-Fenton
Um estudo
realizado por Venkatadri e Peters em 1993, revela que o tratamento convencional
de Fenton é mais vantajoso, em termos de custos de operação e manutenção, do
que os tratamentos envolvendo H2O2/UV e TiO2/UV.
Contudo a formação de lamas férricas revelou-se um grande inconveniente deste
processo. Para aproveitar as vantagens do Fenton e minimizar a formação de
lamas estudou-se a aplicação de radiação ultravioleta como adjuvante na
formação de radicais hidroxilo. Deste modo a mesma concentração de radicais é
obtida utilizando uma menor concentração de ião ferroso. Este processo é
conhecido por Foto-Fenton.
O
Foto-Fenton tem tido bastante sucesso na destruição e mineralização de
pesticidas em meio aquoso e em solos, pois embora a luz não penetre mais de alguns
milímetros no solo, o reagente de Fenton gera radicais hidroxilo mesmo na sua
ausência [2].
Ferro Suportado
Como já
foi referido, uma das maiores desvantagens do tratamento de Fenton convencional
prende-se com a formação de lamas metálicas. A utilização de iões de ferro
suportados numa matriz porosa de zeólito surge como uma alternativa à
utilização de ferro em solução. Deste modo evita-se o problema de formação de
lamas. Apesar de haver alguma remoção do ferro suportado durante o processo de
oxidação, a quantidade é relativamente baixa e não interfere com tratamentos
biológicos posteriores. No entanto essa
remoção pode levar à desactivação do catalisador [7].
2. Materiais e métodos
2.1 Instalações experimentais
As
experiências realizadas neste projecto dividem-se em dois grupos: experiências
em reactor semi-contínuo e experiências em reactor fechado. Nesta secção está
descrita detalhadamente a instalação experimental utilizada em cada grupo.
2.1.1 Reactor semi-contínuo
Um reactor semi-contínuo é entendido como sendo um reactor onde, durante a reacção, os reagentes são alimentados continuamente, sendo a saída dos produtos de reacção realizada em sistema batch. A utilização deste reactor pressupõem o aumento da quantidade de mistura reaccional durante a reacção e por isso apenas é utilizado quando a corrente de alimentação é pequena em relação ao volume do reactor. No caso em estudo, os caudais de alimentação são suficientemente pequenos para que se possa considerar a variação de volume reaccional desprezável ao longo da reacção (Anexo 2).
No anexo 1 estão representadas as características detalhadas do reactor.
Na figura
2 pode observar-se uma representação da instalação experimental.
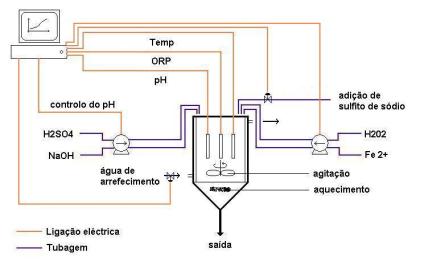
Figura 2 - Instalação para reactor semi-contínuo
Como se pode observar na figura 2, o peróxido e o ferro são alimentados
separadamente, por intermédio de uma bomba peristáltica, e só já dentro do
reactor se juntam para formar o reagente de Fenton. A adição de reagente é
controlada através do computador.
Existem três eléctrodos que permitem monitorizar, em tempo real, as
variações de pH, de temperatura e de ORP. A aquisição das leituras e o controlo
do processo são realizadas através de uma placa de conversão analógica/digital Advantech 818L em conjunto com o software LabView 5.0.
O valor do pH no reactor é controlado em cada instante através da adição de
ácido ou base. O algoritmo de controlo está instalado no computador e é do tipo
proporcional-integral (PI). A variável manipulada é a rotação da bomba de
ácido/base, através da seguinte equação:
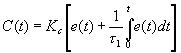 (13)
(13)
Esta instalação permite que se realizem ensaios à escala piloto, com
valores de pH bem definidos e constantes ao longo tempo, verificar a evolução
do ORP e da temperatura ao longo da reacção e observar visualmente o aspecto da
mistura reaccional durante o decorrer do tratamento.
Segurança
O tratamento de Fenton, como já foi referenciado, envolve
transformações químicas exotérmicas.
Essa é a razão da existência de um sistema de segurança, controlado no
computador, e que desenvolve duas acções contra a elevação descontrolada da
temperatura. A primeira acção, que se inicia se a temperatura for superior a 40
ºC, é o abrir da válvula de entrada de água de arrefecimento. Se, em casos
extremos, a temperatura subir acima dos 55 ºC, é descarregada no reactor uma
solução de sulfito de sódio, que reage com o peróxido de acordo com as
seguintes reacções isotermicas:
![]() 2 H2O2 2 H2O + O2
2 H2O2 2 H2O + O2
![]() 2 SO3- + O2 2 SO4-
2 SO3- + O2 2 SO4-
![]()
![]() H2O2 + SO3- H2O + SO4- (14)
H2O2 + SO3- H2O + SO4- (14)
Deste modo pode parar-se a reacção, já que o agente oxidante é consumido,
evitando-se que a temperatura continua a subir.
2.1.2 Reactor Fechado
O ensaios em reactor fechado foram efectuados na instalação esquematizada
na figura 3.
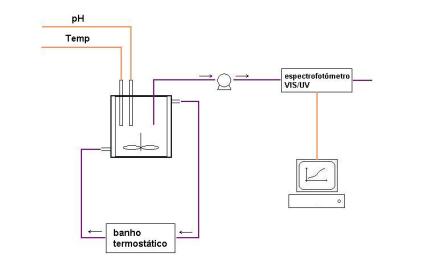
Figura 3 - Instalação para reactor fechado
Utiliza-se um reactor fechado, de vidro, cujas características detalhadas
se pode encontrar no Anexo 3.
Como se observa na figura, a temperatura no reactor encontra-se
termoestatizada. É possível medir o valor do pH e da temperatura através de
dois eléctrodos ligados a um medidor. Durante a reacção um pequeno caudal é
continuamente retirado do reactor e transportado até ao espectrofotómetro onde
se processa à medição da absorvância.
Através de um sistema de aquisição em tudo semelhante ao descrito
anteriormente, os valores de absorvância lidos são registados no computador ao
longo da reacção.
Nesta, instalação, visivelmente mais simples que a de reactor
semi-contínuo, não há considerações de segurança já que a ocorrência de runaway é muito improvável.
2.2 Carbono Orgânico Total (TOC)
As medições de TOC são efectuadas recorrendo a um aparelho Shimadzu TOC – 5000 A. O principio de
funcionamento deste aparelho permite determinar a quantidade de carbono total,
bem como a quantidade de carbono inorgânico na amostra. Por diferença obtém-se
o carbono orgânico total em mg de carbono por litro de amostra.
O método de obtenção das amostras para posterior análise de TOC, baseia-se
em retirar do reactor um volume conhecido de mistura reaccional e promover a
sua mistura rápida com volume conhecido de solução concentrada de sulfito de
sódio. Deste modo, e como já foi referido, pode parar-se a reacção de oxidação
e inferir sobre o teor de TOC na amostra inicialmente retirada. Um exemplo de
cálculo deste método está apresentado no apêndice 4.
2.3 Caracterização dos efluentes
Dois efluentes foram sintetizados para efectuar as experiências neste
projecto:
Nas experiências realizadas em reactor semi-contínuo, o efluente utilizado
é uma solução de aquosa de sacarose.
Esta solução apresenta um teor de TOC aproximadamente igual a 900 mgC/L e uma
CQO de aproximadamente 2500 mgO2/L. Estes valores são obtidos para a
concentração de 1,7 g de sacarose por litro.
Nas experiências em reactor fechado utiliza-se um efluente aquoso corado de violeta de cristal (C25H30ClN3)
5 x 10-5 M. O teor em TOC
deste efluente é aproximadamente 14,3 mgC/L.
3. Descrição das experiências
Tal como foi mencionado, as experiências dividem-se em dois grupos. No
primeiro grupo, realizado no reactor semi-contínuo à escala piloto, estudou-se
a remoção de TOC do solução aquosa de sacarose. O avanço da reacção foi
monitorizado pelo ORP e pela temperatura. Nestas experiências conclui-se sobre
a aplicabilidade destes métodos como possíveis critérios de paragem da reacção.
No segundo grupo de experiências, realizado em reactor fechado, estudou-se
a remoção de cor de um efluente corado, tendo a reacção sido seguida através da
medição da absorvância. Determinou-se as condições óptimas de operação em
termos de pH, temperatura, dosagem de reagente de Fenton e razão Fe:H2O2.
3.1 Experiências em reactor semi-contínuo
3.1.1 Descrição experimental
Utilizando a instalação descrita na secção 2.1.1, introduziu-se no reactor
12 litros de solução aquosa de sacarose, com concentração de 1,7 g/L e
aqueceu-se a solução até 30 ºC. A reacção foi conduzida a pH 3,5 conforme o
sugerido na literatura consultada.
O reagente de Fenton é composto pela mistura de iguais volumes de uma
solução de H2O2 a 100 vol e de FeSO4.7H2O
0,99 M. Estas soluções são
alimentadas separadamente ao reactor, em caudais iguais a 5,84 cm3/L.
Desta forma, o reagente de Fenton é alimentado a um caudal global de 11,67 cm3/min
e com uma razão mássica de Fe:H2O2 igual a 1:5.
Durante a realização desta experiência foram retiradas várias amostras de
mistura reaccional para posterior análise de TOC. Utilizou-se uma solução de
sulfito de sódio 2 M como meio de
paragem da reacção na amostra retirada. Deste modo é possível determinar o teor
de TOC presente no reactor nesse instante. (Anexo
4).
A adição de reagente de Fenton foi interrompida quando os valores de ORP e
de temperatura estabilizaram. Antes da descarga final neutralizou-se o
efluente.
3.1.2 Resultados e discussão
Seguidamente são apresentados graficamente os resultados obtidos pelo sistema de aquisição de dados, durante a realização da experiência.
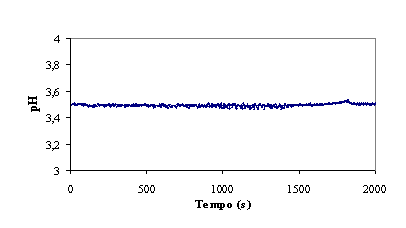
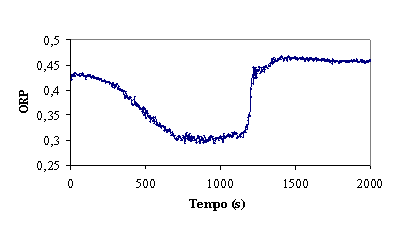
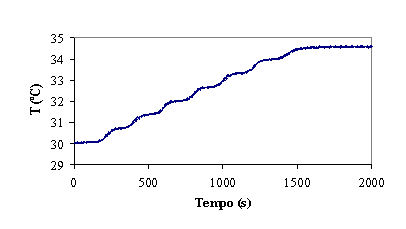
Figura 4 – Evolução do ORP, temperatura e pH no decorrer da experiência
pH
A adição do reagente de Fenton, bem como o avanço da reacção, diminui o pH
da mistura reaccional, nomeadamente pela formação de ácidos resultantes da
oxidação da matéria orgânica. (ver figura
1)
Pela análise da evolução do pH ao longo da reacção, pode apenas concluir-se
que o sistema de controlo é eficiente.
ORP
A adição de reagente de Fenton provoca um aumento do ORP, uma vez que os radicais hidroxilo gerados são
espécies muito oxidantes. Por outro lado, o avanço da reacção e o inerente
consumo de radicais provoca uma diminuição
do valor do ORP. A curva do ORP apresentada na figura 4, resulta da soma destes
dois efeitos contrários. Logo após o início da adição do reagente de Fenton não
se nota uma variação significativa do ORP, pois a concentração de radicais
hidroxilo em solução é ainda baixa. A depressão acentuada verificada de
seguida, corresponde ao intervalo de tempo em que o consumo de radicais é
superior à quantidade de radicais formados pelo reagente de Fenton. Supõe-se, então,
que a velocidade máxima de reacção ocorre por volta dos 1000 seg.
A partir desta altura verifica-se um aumento do valor do ORP, o que
supostamente indica uma diminuição da velocidade de consumo de radicais
hidroxilo, isto é, um abrandamento da reacção. Depois do abrandamento da
reacção, a adição de reagente de Fenton não se reflecte numa variação de ORP, o
que se pode verificar pela formação do patamar final, aproximadamente a partir
do 1500 seg.
Temperatura
À medida que se adiciona reagente de Fenton a temperatura vai aumentando
devido ao facto da reacção ser exotérmica. A formação de um patamar final ainda
durante a adição de reagente de Fenton, dá indicação do abrandamento da
reacção. Porém, visto que a temperatura não desce, supõe-se que esta não tenha
ainda parado completamente.
As oscilações cíclicas na subida da temperatura não têm uma causa evidente
e podem ficar a dever-se a um qualquer problema no sistema de aquisição. Porém,
este facto não impede de relacionar o aumento de temperatura com o avanço da
reacção.
Temperatura e ORP
Estes são dois dos métodos possíveis para monitorizar o avanço da reacção.
A figura 5 compara a evolução destes dois parâmetros ao longo da reacção.
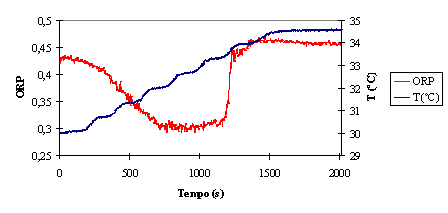
Figura 5 – Comparação da evolução da temperatura e ORP
Como se pode observar, a estabilização do ORP é acompanhada pela
estabilização da temperatura. Para efeitos práticos, pode dizer-se que a
temperatura e o ORP acompanham do mesmo modo o andamento da reacção.
O próximo passo é relacionar a evolução destes dois parâmetros com a
variação efectiva de matéria orgânica, medida em termos de TOC.
TOC
Os resultados das análises de TOC realizados ao longo tempo de reacção
estão apresentados na figura seguinte.
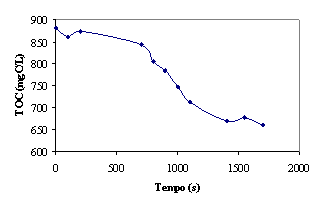
Figura 6 – Evolução da concentração de TOC no reactor
Estes resultados mostram que o reagente de Fenton conseguiu reduzir o teor
de matéria orgânica desde, sensivelmente, 900 até 650 mgC/L, o que corresponde
a uma remoção de cerca de 28 %.
O valor final de matéria orgânica no efluente é ainda elevado. Nota-se,
porém, que o prolongamento do tratamento não conduz a um aumento de remoção de
matéria orgânica.
TOC e ORP
Na figura 7 estão sobrepostas as evoluções do TOC e do ORP.
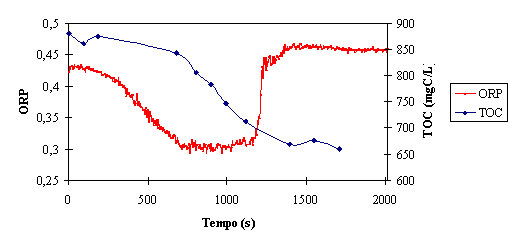
Figura 7 – Comparação da evolução do ORP e do TOC dentro do reactor
Pode observar-se que a diminuição do TOC é mais rápida na zona em que o ORP
apresenta valores mínimos. Estes resultados confirmam a suposição, já
apresentada na secção 3.1.2 - ORP, de que a este intervalo de tempo corresponde
a velocidade máxima de reacção. Estes resultados permitem ainda concluir que o
ORP é, efectivamente, um método adequado para a monitorização da evolução da
reacção. Pode utilizar-se a formação do patamar final do valor do ORP como
critério de paragem de adição de reagente de Fenton, já que, a partir deste
ponto, a remoção de matéria orgânica conseguida não é significativa.
TOC e temperatura
Pode observar-se a sobreposição das evoluções do TOC e da temperatura na
figura 8.
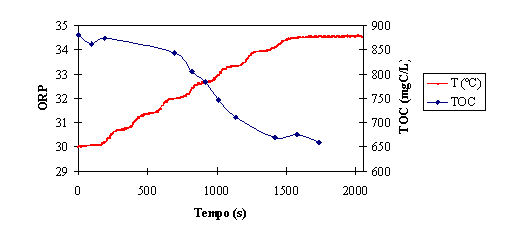
Figura 8 – Comparação da evolução do ORP e da temperatura dentro do reactor
Tal como acontece com o valor de ORP, verifica-se uma relação entre a
remoção de matéria orgânica e o aumento de temperatura. A temperatura da
mistura reaccional deixa de aumentar quando a remoção de TOC abranda. Assim,
parece também válido utilizar a temperatura como critério de paragem do
tratamento.
A utilização da temperatura é, no entanto, mais limitada, já que apenas
informa acerca do ponto de paragem, dando pouca informação sobre a evolução da
reacção. Além disso, é um método mais sensível a influências externas,
nomeadamente a factores que influenciem a transferencia de calor do reactor
para o exterior.
Sugere-se, então, a utilização do valor do ORP e da temperatura, em
conjunto, como métodos de monitorização e critério de paragem do tratamento de
Fenton.
3.2 Experiências em reactor fechado
3.2.1 Descrição experimental
Utilizando a instalação descrita na secção 2.1.2, procedeu-se ao tratamento
de Fenton em reactor fechado de uma solução aquosa corada de violeta de crital
5 x 10-5 M. O comprimento
de onda utilizado no espectrofotómetro corresponde ao máximo de absorvância do
referido corante e é de 588 nm.
Um volume de aproximadamente 250 ml de solução corada foi introduzido no
reactor. Através do banho termostático e de adições de ácido ou base fixou-se
primeiro a temperatura e depois o pH da solução. O peróxido e o ferro foram
adicionados separadamente. O ferro foi adicionado sob a forma de FeSO3.7H2O
sólido, deixando-se dissolver. O peróxido foi adicionado depois, correspondendo
esse momento de adição ao tempo zero de reacção.
Realizou-se ensaios para estudar a influência do pH inicial, da razão
mássica Fe:H2O2, da dosagem de reagente de Peróxido e da
temperatura, na eficiência de remoção de cor.
Na tabela 4 estão sumariadas as condições operatórias dos 15 ensaios
realizados.
Tabela 4 – Condições operatórias dos ensaios em reactor fechado
|
N.º |
pH |
Fe : H2O2 |
Dosagem de Peróxido
(g / L) |
Temperatura (ºC) |
|
1 2 3 4 5 6 7 2 8 9 2 10 11 12 13 14 15 11 |
2,5 3 3,5 4 5 3 3 3 3 3 3 3 3 3 3 3 3 3 |
1:5 1:5 1:5 1:5 1:5 1:1 1:2 1:5 1:7 1:10 1:5 1:5 1:5 1:5 1:5 1:5 1:5 1:5 |
0,1578 0,1578 0,1578 0,1578 0,1578 0,1578 0,1578 0,1578 0,1578 0,1578 0,1578 0,1263 0,0947 0,0631 0,0317 0,0947 0,0947 0,0947 |
30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 20 25 30 |
3.2.2 Resultados e discussão
Nesta secção observa-se e discute-se a evolução da absorvância da solução
corada, para as várias condições operatórias.
As curvas de absorvância apresentadas representam o valor relativo à
absorvância inicial da solução corada, antes do tratamento.
![]()
pH
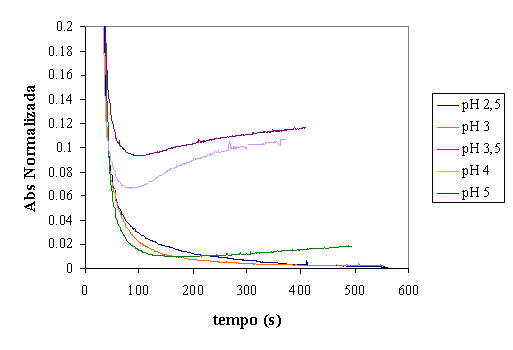
Figura 9 - Evolução da absorvância para diferentes valores de pH em reactor fechado
Como se pode observar na figura 9, o pH inicial do efluente influencia
bastante o desenrolar do tratamento. A análise dos resultados da variação do pH
pode dividir-se em duas secções: pH menor que 3,5 e pH igual ou superior a 3,5.
Esta divisão é pertinente pois verifica-se uma alteração de comportamento entre
os ensaios a pH=3 e a pH=3,5.
Como primeira análise, observe-se as curvas de pH=2,5 e pH=3. A diminuição
de absorvância é mais rápida no ensaio a pH=3. Subindo o valor de pH para 3,5
nota-se também que a velocidade de diminuição de absovância aumenta. Porém, por
volta dos 150 seg. existe um aumento da absorvância, motivado pela súbita
turvação do efluente. Esta turvação, que corresponde possivelmente a uma
formação de precipitado de ferro, vai tornar desinteressante a utilização de
valores iniciais de pH superiores a 3.
Definindo a percentagem de remoção de cor como sendo:
![]()
pode observar na figura 10, a remoção de cor aos 200 seg de reacção para os
diferentes valores de pH. O valor de pH que origina uma maior percentagem de
remoção de cor é pH=3.
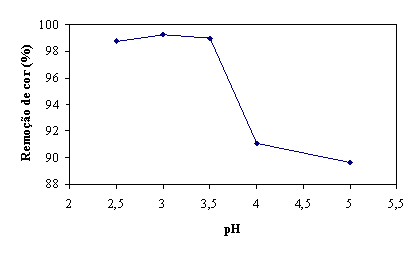
Figura 10 - Remoção de cor aos 200 seg em função do valor de pH
Razão Ferro:Peróxido
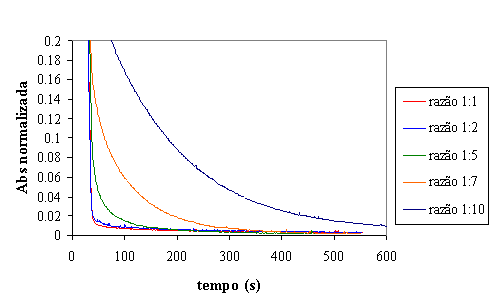
Figura 11 - Evolução da absorvância para diferentes valores de Fe:H2O2 em reactor fechado
Da observação da figura 11 conclui-se que a diminuição da absorvância é
tanto mais rápida quanto maior é a razão Fe:H2O2. A
quantidade de Ferro parece influenciar bastante a velocidade de reacção e não o
valor de absorvância mínimo que se pode obter. Este facto pode ser constatado
verificando que as curvas de absorvância tendem para um mesmo valor final,
qualquer que seja a razão Fe:H2O2. O que varia é,
sobretudo, a velocidade com que se atinge a máxima remoção.
Considerando, novamente, o valor de referência de 200 seg. nota-se que não
é necessária a utilização uma maior dosagem de Ferro que a correspondente à
razão de 1:5. Este facto pode ser observado na figura 12.
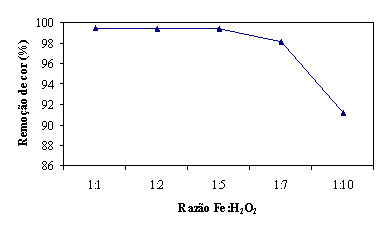
Figura 12 - Remoção de cor aos 200 seg em função da razão Fe:H2O2
Dosagem de Peróxido
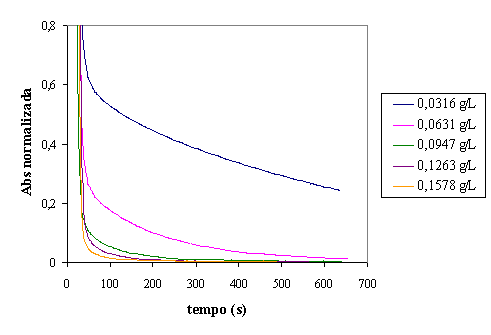
Figura 13 - Evolução da absorvância para diferentes dosagens de H2O2 em reactor fechado
À semelhança do que acontece com a razão Fe:H2O2,
também o aumento da dosagem de peróxido influencia a evolução da absorvância.
Concentrações mais altas em peróxido favorecem a velocidade de diminuição de
absorvância. A figura 14 permite concluir que uma remoção de cor aceitável é
conseguida para uma dosagem de 0,0947 g/L. Concentrações maiores não conduzem a
um aumento significativo de remoção.
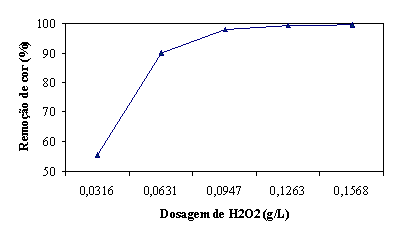
Figura 14 - Remoção de cor aos 200 seg em função da dosagem de H2O2 (g/L)
Temperatura
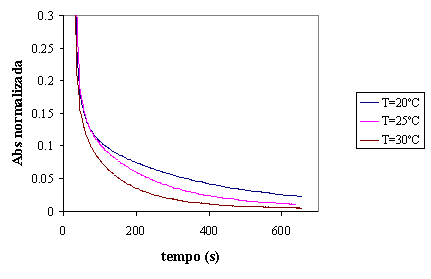
Figura 15 - Evolução da absorvância para diferentes valores de temperatura em reactor fechado
Os ensaios a temperatura diferente foram realizados para confirmar a
diminuição de eficiência de remoção de cor com a diminuição de temperatura do
meio reaccional.
Como se pode observar no valor de remoção de cor aos 200 seg. à temperatura
mais alta corresponde a maior eficiência de remoção de cor. Ver figura 16.
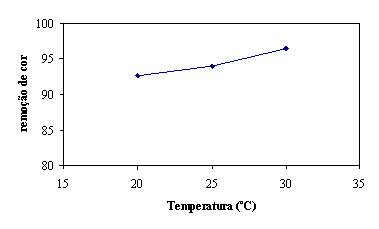
Figura 16 - Remoção de cor aos 200 seg em função da temperatura
Comentário global a todos os ensaios
De acordo com os ensaios efectuados, as condições óptimas para a remoção de
cor do efluente estudado são:
·
pH=3
·
razão Fe:H2O2
= 1:5
·
Dosagem de
peróxido = 0,0947 g/L
Na gama de temperaturas estudadas, a maior remoção de cor é obtida a 30 ºC.
Se a temperatura da mistura reaccional for superior a remoção de cor será ainda
mais rápida, como foi referido na secçao 1.2.2 – Temperatura.
Nestas condições, a percentagem de remoção de cor obtida, no final da
reacção é de aproximadamente 99 %.
A remoção de TOC obtida, após análise do efluente resultante do tratamento
nestas condições, é de 67 %, à qual corresponde um valor de TOC de 4,7 mg C/L.
Como se pode observar em todas as evoluções da absorvância ao longo do
tempo, a diminuição de absorvância nos primeiros segundos é muito rápida.
Este facto pode ficar a dever-se à mudança de cor que se observa no início
do tratamento. A própria mudança de cor leva a uma diminuição brusca de absorvância,
sem que exista uma remoção efectiva de cor. Essa diminuição fica apenas a
dever-se ao facto da nova cor não apresentar o máximo de absorvância no
comprimento de onda seleccionado, 588 nm.
Esta diminiução brusca pode também indicar que o tempo de passagem no tubo
de alimentação ao espectrofotómetro é demasiado grande e que a reacção se
processa durante este tempo. O comportamento dentro do tubo aproxima-se de um
reactor pistão. Assim, quando a amostra chega ao espectrofotómetro apresenta já
uma cor que não corresponde à que tinha no momento de amostragem. Este facto
não interfere na determinação das condições óptimas de operação, uma vez que é
comum a todos os ensaios.
Para uma melhor percepção da remoção de cor obtida ao longo do tempo pode
observar-se as fotografias (figura 17) do efluente no decorrer da experiência.



Figura 17 – Evolução da cor do efluente no decorrer da experiência
4. Conclusões
O seguimento da reacção de Fenton pode ser monitorizado através do valor de
ORP da mistura reaccional. Pode também utilizar-se a medição de temperatura
para o mesmo efeito, no entanto é aconselhável a utilização dos dois métodos
para uma monitorização mais eficiente.
O reagente de Fenton pode ser utilizado na remoção de cor e de TOC em
soluções de violeta de cristal. As condições óptimas de operação para uma
concentração de violeta de cristal 5´10-5 M são as seguintes:
-
pH = 3
-
razão Fe:H2O2
= 1:5
-
Dosagem de H2O2
= 0,0947 g/L
Nestas condições e a 30 ºC, obteve-se uma remoção de cor de 99 % e uma
remoção de TOC de 67 %.
5. Propostas para investigações futuras
O passo mais importante que poderá ser dado em investigações futuras é
estudar a aplicabilidade do tratamento em efluentes reais, em substituição dos
efluentes sintetizados utilizados neste trabalho.
Tal como apresentado na secção 1.2.3, a etapa de coagulação inerente ao
tratamento de Fenton pode desempenhar um papel relevante na remoção de matéria
orgânica dos efluentes. Esta etapa poderá também ser abordada em estudos
futuros de modo a poder tirar-se partido desta característica do tratamento de
Fenton.
Outro aspecto interessante será a introdução de radiação ultravioleta na
etapa de oxidação, tal como descrito na secção 1.5 – Foto-Fenton.
6. Bibliografia
[1] Guedes, A. M. F. M, Oxidação
Química com Reagente de Fenton: Aplicação às águas de cozimento da cortiça,
Tese de Mestrado, Faculdade de Engenharia da Universidade do Porto, Novembro de
1998.
[2] Higarashi, M. M.; Moreira, J.C.; Oliveira, A. S.; Ferreira,
L.F.V., A Utilização de Processos
Oxidativos Avançados na Descontaminação do Meio Ambiente, 2000.
[3] Fenton, H.J.H., On a New Reaction of Tartaric Acid (Letter to the editor), Chemical
News, 1876.
[4] Flaherty, K. A.; Huang, C. P., Continuous Flow Applications of Fenton’s
Reagent for the Treatment of Refractory Wastewaters.
[5] www.h202.com
[6] Bigda, R.J., Consider Fenton’s Chemistry for Wastewater Treatement, Chemical
Engineering Progress, 62-66, December 1995.
[7] Centi, G.; Cimino, G.; Grasso, G.;
Perathoner, S.; Romeo, G.; Toscano, G., Catalytic
Wet H2O2 Oxidation of Olive Oils Mills Wastewater:
Development of a Fe/ZSm-5 Catalytic System, http://preprint.chemweb.com/chemeng/0011003,
7 November 2000.
[8] Kang e Hwang, Effect of Reaction Conditions on the Oxidation Efficiency in the Fenton
Process, Water Research, vol. 34, nº 10, pp. 2786-2790, 2000.
[9] Kang e Shang, Coagulation of Textile Secondary Effluents with Fenton’s Reagent,
Water Science Technology, vol. 30, nº 12, pp. 215-222, 1997
[10] Lin e Lo, Fenton
Process for Treatment of Desizing Wastewater, Water Research. vol. 31, nº
8, pp. 2050-2056, 1997.
Anexo 1 – Reactor semi-contínuo
Anexo 2 – Variação de volume em reactor semi-contínuo
Volume de mistura reaccional inicial, Vi
Volume de mistura reaccional final, Vf
Caudal volúmico de alimentação de reagente, Qe
Vi = 12 dm3
Qe = 11,67 cm3/min
Para que a variação de volume atingisse 5% do valor inicial, Vf teria de atingir o valor de:
Vf = Vi .(
1,05 ) = 12,6 dm3
O que corresponderia a um tempo de alimentação de:
![]()
Os tempos de reacção estudados são menores que este e por isso está
assegurado uma variação de volume inferior a 5%, o que a torna desprezável.
Anexo 4
- Exemplo de cálculo do teor de TOC
Num balão volumétrico de 50,0 ml são previamente depositados 2,00 ml de
solução de sulfito de sódio. A concentração desta solução é calculada para
garantir que a reacção de oxidação cesse imediatamente ainda que no reactor
esteja uma concentração máxima de peróxido de hidrogénio (ver eq. (14)). A concentração máxima, [H2O2]max, corresponde à situação
de todo o peróxido ficar retido no reactor sem reagir. Utilizando 500 ml de uma
solução de peróxido a 100 vol, num volume de 12 litros, obtém-se [H2O2]max
= 0,37 M.
Assim,
Vamostra = 10,00 ml
![]()
pela equação (14):
![]()
A quantidade de sulfito terá de ser capaz de consumir todo o peróxido existente na amostra. Para tal, a concentração da solução de sulfito terá de ser:
![]()
A concentração de sulfito de sódio utilizada é de 2 M.
As amostras são refrigeradas a 5ºC até ao momento da análise de TOC.
Nessa altura efectua-se a diluição até 50,0 ml e a filtração por vácuo.